
Hiermit bestätige ich, dass ich einen medizinischen oder pharmazeutischen Beruf ausübe [Ärzt*in, Apotheker*in, Pharmazeutisch-technische*r Assistent*in (PTA), Medizinische*r Fachangestellte*r (MFA)].
Dengue
Reisemedizin
Steckbrief
Dengue-Fieber ist die häufigste tropenspezifische Viruserkrankung, die nach Deutschland importiert wird. Klinisch handelt es sich um eine akute, hoch fieberhafte Erkrankung mit Myalgien, Kopfschmerzen und variablem Exanthem. Bei Reinfektion kann es zu hämorrhagischem Dengue-Fieber oder Dengue-Schocksyndrom kommen. Eine spezifische Therapie gibt es nicht. Seit Anfang 2023 ist in Europa eine neue Impfung gegen Dengue-Fieber verfügbar.
Abkürzungen
- ADE: Antibody dependent Enhancement
- DHF: Dengue hemorrhagic Fever
- Ig: Immunglobulin
- RNA: Ribonukleinsäure
- RT-PCR: Reverse Transcriptase Polymerase Chain Reaction
- WHO: World Health Organisation
Einführung
Im Jahr 2019 erklärte die WHO (World Health Organisation) Dengue zu einer der 10 größten globalen Gesundheitsbedrohungen [ 1 ] . Dies hat einen guten Grund: Die Flavivirusinfektion ist zu einer globalen Pandemie angewachsen, die unmittelbaren Effekt auf das Leben eines wesentlichen Teiles der Menschheit hat. Im Westen wurde die Infektion lange ignoriert, da die Überträgermücken in temperierten Klimazonen nicht oder nur selten vorkamen. Aber das ändert sich: Dengue ist die sich weltweit am schnellsten ausbreitende, durch Mücken übertragene Viruserkrankung. Von ihr sind jährlich mehr als 300 Millionen Menschen betroffen. In den vergangenen 40 Jahren hat sich die Dengue-Inzidenz verdreißigfacht [ 2 ] . Dengue verursacht jährlich 20 000–25 000 Todesfälle, vor allem bei Kindern, und ist in mehr als 100 Ländern verbreitet. Jedes Jahr treten in immer mehr Ländern Epidemien auf. Betroffen sind vor allem Lateinamerika und Asien, jedoch verzeichnen auch Afrika und Ozeanien regelmäßig größere Ausbrüche. Aktuell ist das Dengue-Fieber in mehr als 128 Ländern insbesondere in den Tropen und Subtropen endemisch ( [ Abb. 1 ] ) [ 3 ] . In Asien und Lateinamerika gehört Dengue zu den Haupttodes- und -hospitalisierungsursachen bei Kindern und Erwachsenen [ 4 ] . Im August 2023 verhängte Guatemala den Notstand wegen der hohen Zahl an Dengue-Erkrankungen im Land. Brasilien meldete mehr als 2,5 Millionen Fälle, und kleinere Cluster wurden in Italien registriert [ 5 ] .
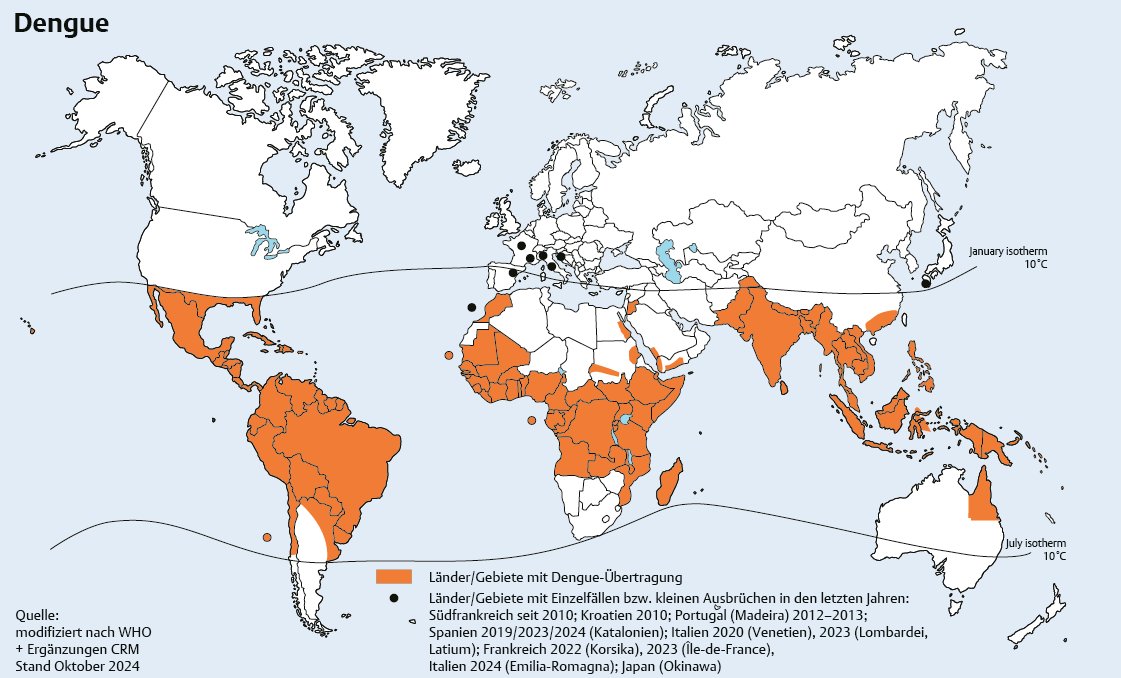
Abb. 1 Dengue-Fieber: geografische Verbreitung. Quelle: Jelinek T. CRM Handbuch Reisemedizin 2025. 61. Auflage. Düsseldorf: CRM Centrum für Reisemedizin; 2024.
Das Dengue-Virus ist ein RNA-Virus (Ribonukleinsäure-Virus), das zur Familie der Flaviviren gehört. Tatsächlich existieren weltweit 4 verschiedene Serotypen, die mit DEN1 bis DEN4 bezeichnet werden. Diese Serotypen weisen nur eine relativ geringe Sequenzhomologie auf (ca. 70%), die sich insbesondere in Unterschieden im Hüllprotein der Viren manifestiert. Da die primäre Immunantwort des Menschen gegen dieses Protein gerichtet ist, besteht nach einer durchgemachten Infektion nur eine sehr kurze Kreuzprotektion gegen alle Serotypen. Diese ist über 2 bis maximal 6 Monate nachweisbar und basiert vermutlich wesentlich auf der zellulären Immunität. Im Anschluss schützen die über Jahre verbleibenden Antikörpertiter gegen eine erneute homologe Infektion mit demselben Serotyp, nicht jedoch gegen heterologe Infektionen mit anderen Serotypen. Somit muss eine Dengue-Infektion insgesamt viermal durchlaufen werden, bevor eine vollständige Immunität erreicht ist. Die Verbreitung der 4 Serotypen variiert global. Am häufigsten werden durch DEN2 und DEN1 verursachte Ausbrüche gesehen, gefolgt von Typ 3 und dem seltenen Typ 4.
Aedes aegypti wird mit den meisten Infektionen in Verbindung gebracht. Jedoch dehnt sich das Verbreitungsgebiet von Aedes albopictus aus, da diese Mücke kalte Umgebungen besser verträgt und sich aggressiv sowie in großer Zahl verbreitet. Beide Mückenarten sind sehr effektive Vektoren, weil sie ihre Blutmahlzeit oft unterbrechen und dabei auch mehrere Menschen kurz hintereinander stechen. Da die Viren bei jedem Stich erneut mit dem Speichel übertragen werden, erhöht sich so die Zahl der Infektionen erheblich. Diese tagaktiven Stechmückenarten sind Kulturfolger und leben in der Regel im urbanen Umfeld. Beide legen ihre Eier in stehende Gewässer. Dabei ist Aedes aegypti perfekt an die urbane Umgebung angepasst und nutzt dafür z.B. Eimer, Blumentöpfe, Autoreifen oder Pfützen. Aedes albopictus kommt ebenfalls in Städten vor, aber auch in der Vorstadt sowie in ländlichen Gebieten [ 2 ] . Heute ist Aedes albopictus auch in Süd- und Zentraleuropa heimisch (darunter auch in Teilen Deutschlands). In Kroatien, Frankreich, Spanien und Italien hat es in den letzten Jahren regelmäßig kleinere autochthone Dengue-Ausbrüche gegeben [ 6 ] .
Ein nennenswertes Risiko für größere Ausbrüche wird für Europa nicht vorausgesagt. Jedoch ist vor allem im Südwesten Deutschlands die Übertragung von Dengue auf lokale Mückenpopulationen durch virämische Reiserückkehrer im Sommer realistisch. Dies könnte zu lokal begrenzten Ausbrüchen führen, wie schon in anderen europäischen Ländern geschehen. Eine endemische Situation ist auf absehbare Zeit nicht anzunehmen, da der Winter die Übertragung regelmäßig beendet und es dann zu einer Neueinschleppung der Viren durch infizierte Reisende kommen muss.
|
Merke Die Hauptüberträger der Infektion sind weibliche Mücken der Arten Aedes aegypti und Aedes albopictus, aufgrund ihrer markanten Körperzeichnung oft auch Tigermücken genannt. |
Immunreaktion und Pathophysiologie
Infektionen verlaufen bei ca. 50% der infizierten Menschen asymptomatisch, einzelne Quellen geben sogar bis zu 70% an [ 4 ] . Bei symptomatischen Patienten kann nach der Infektion ein Spektrum von Manifestationen auftreten, das vom selbstlimitierenden Dengue-Fieber bis hin zu Blutungen und Schock reicht ( [ Abb. 2 ] ). Bei einem Teil der Infektionen (0,5–5,0%) kommt es zu einem schwer verlaufenden Dengue-Fieber. Ohne angemessene Behandlung kann die Sterblichkeitsrate 20% übersteigen. Diese Fälle treten in Endemiegebieten vor allem bei Kindern auf, da dort die Infektion im frühen Lebensalter erfolgt. Die typische Inkubationszeit der Krankheit beträgt 4–7 Tage, sie kann aber auch 3–10 Tage dauern.
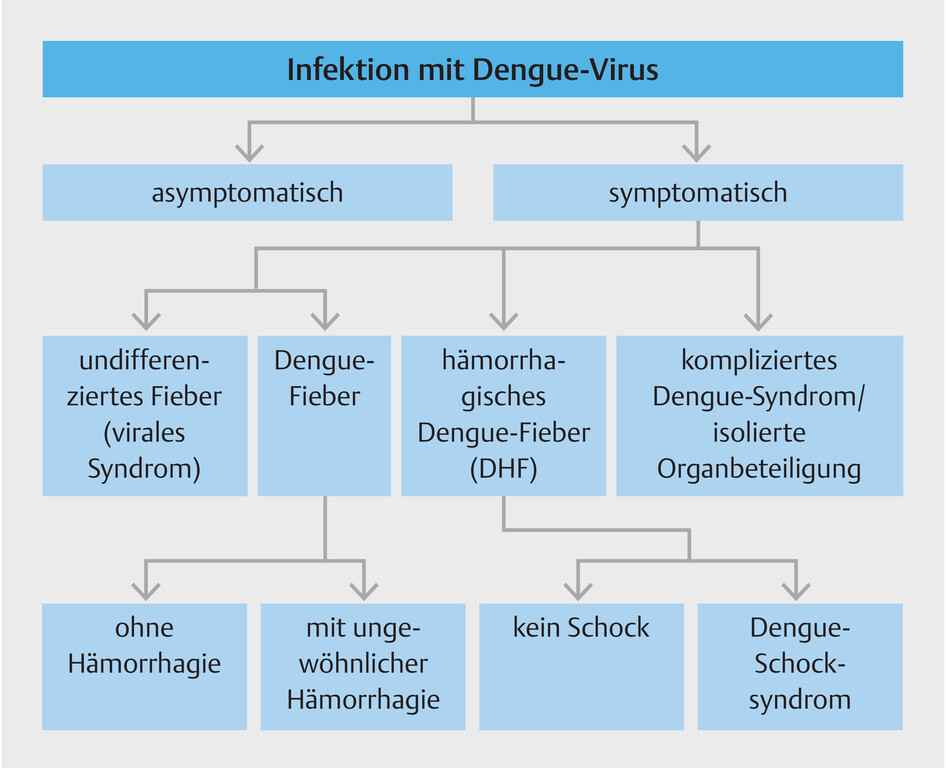
Abb. 2 Manifestationen der Dengue-Erkrankung laut WHO-Definition [ 7 ] .
|
Merke Treten die Symptome mehr als 2 Wochen nach der Exposition auf, ist es unwahrscheinlich, dass sie auf Dengue-Fieber zurückzuführen sind. |
Nach einer Infektion besteht eine lebenslange Immunität gegen den Serotyp, der die durchgemachte Infektion verursacht hat, aber keine Kreuzimmunität gegen die verbleibenden Serotypen [ 8 ] .
Nach der Injektion des Dengue-Virus durch einen Mückenstich scheinen Hautmakrophagen und dendritische Zellen die ersten Ziele zu sein [ 9 ] . Es wird angenommen, dass die infizierten Zellen dann in die Lymphknoten wandern und sich über das Lymphsystem auf andere Organe ausbreiten. Die Virämie kann bereits 48 h vor dem Auftreten der Symptome vorhanden sein und klingt innerhalb von 1–2 Tagen nach Beginn der Beschwerden ab. In der Virämie kommt es zu einem komplexen Zusammenspiel von Wirts- und Virusfaktoren, das darüber entscheidet, ob die Infektion asymptomatisch, typisch oder schwer verläuft. Dabei hat die Fähigkeit zur Replikation der Viren einen wichtigen Einfluss. Insgesamt verlaufen Infektionen mit Dengue Typ 2 tendenziell schwerer, während Infektionen mit den anderen Serotypen in absteigender Reihenfolge 1, 3 und 4 zu weniger Komplikationen neigen.
|
Merke Einen wesentlichen Einfluss auf die Pathogenese von Komplikationen von Dengue hat auch die Immunreaktion des Wirtes. |
Insbesondere die Manifestation von DHF (Dengue hemorrhagic Fever), das mit erhöhter mikrovaskulärer Permeabilität, Abfall der Thrombozytenzahl, Blutungsneigung und Schocksyndrom einhergeht, wird durch eine überschießende Immunreaktion getriggert. Diese kann sich insbesondere bei Zweitinfektionen etablieren. Das beruht auf einem Phänomen, das als ADE (Antibody dependent Enhancement) bezeichnet wird. Demnach bilden bei einer vorherigen Infektion gebildete Antikörper gegen das Hüllprotein der Viren (Envelope-Antigen) aufgrund einer immunologischen Kreuzreaktion bei einer erneuten Infektion mit einem anderen Serotyp Immunkomplexe mit dem Erreger. Diese Komplexe binden an Fc-Rezeptoren auf Monozyten, inhibieren in der Folge die angeborene antivirale Immunantwort und erlauben damit eine starke Virusreplikation [ 10 ] . Dabei scheint insbesondere auch eine mangelnde Immunantwort gegen das NS1-Antigen der Viren bei der Erstinfektion eine Rolle zu spielen [ 11 ] . Dieses Antigen liegt bei allen 4 Serotypen homolog und hochkonserviert vor. Parallel zur Virämie wird NS1 freigesetzt, das sich an den Kapillarendothelien anlagert und eine Zellschädigung hervorruft. Diese leistet vermutlich der zellulären Virusaufnahme Vorschub. Wird das Antigen durch die bereits bestehende Immunität nach Erstinfektion blockiert, ist der Krankheitsverlauf eher komplikationsarm. Ist dies nicht der Fall, kommt es eher zu Komplikationen. Es gibt jedoch auch Fälle von schwerem Dengue-Fieber bei einer Infektion mit nur einem einzigen Serotyp.
Klinik
Klassisches Dengue-Fieber
In der febrilen Phase ( [ Abb. 3 ] ) tritt ein plötzliches hohes Fieber von etwa 40°C auf, das in der Regel 2–7 Tage anhält [ 10 ] . Zu den begleitenden Symptomen gehören Myalgien, Arthralgien, Kopfschmerzen, Halsschmerzen, Bindehautinfektionen, Anorexie, Übelkeit und Erbrechen. Im angelsächsischen Sprachgebrauch hat sich der Begriff des Break Bone Fever etabliert, da die Gliederschmerzen oft sehr ausgeprägt sind und von den Patienten meist als das führende Symptom empfunden werden. Ein makulöses, reizloses, oft stammbetontes Exanthem manifestiert sich häufig an Tag 4–5 nach Symptombeginn ( [ Abb. 4 ] ). Eindrucksvoll ist in vielen Fällen ein deutlicher Dermografismus ( [ Abb. 5 ] ).
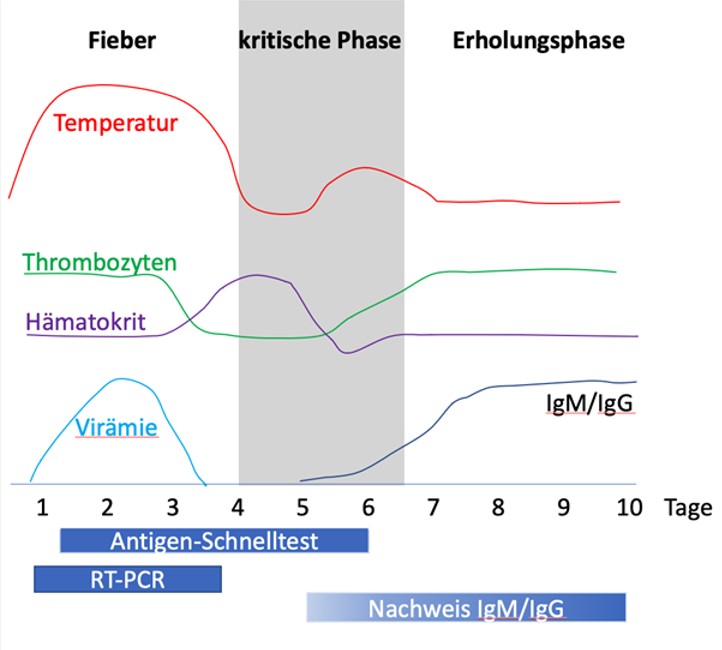
Abb. 3 Dengue-Fieber: Krankheitsverlauf und Diagnostik [7]
IgM/IgG = Immunglobulin M/G; RT-PCR = Reverse Transcriptase Polymerase Chain Reaction
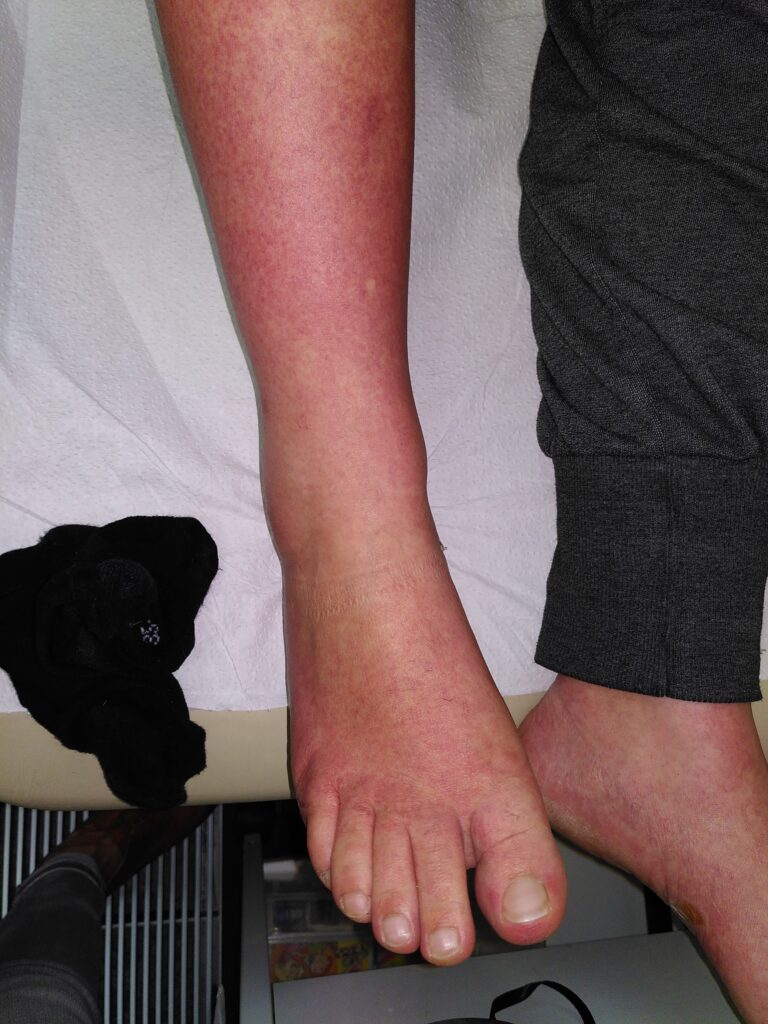
Abb. 4 Makulöses Exanthem bei Dengue
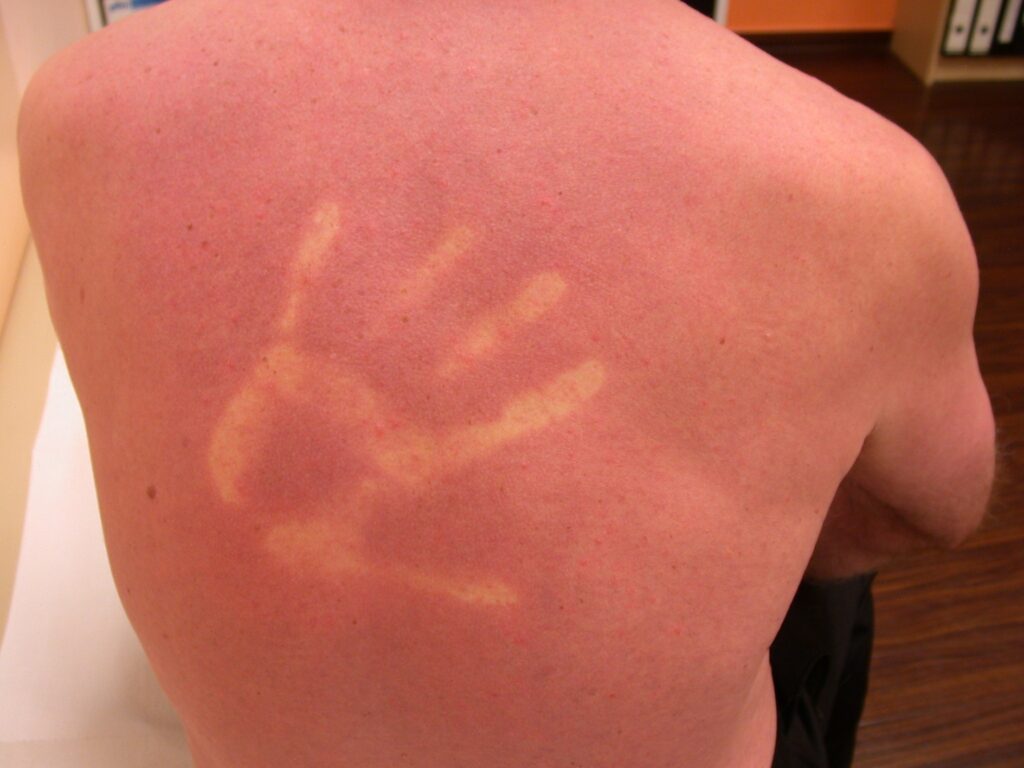
Abb. 5 Makulöses Exanthem und Dermografismus bei Dengue-Fieber
|
Fallbeispiel Gliederschmerzen bei Dengue-Fieber Eine 48-jährige Patientin stellt sich in der Sprechstunde direkt nach ihrem Urlaub in Südfrankreich vor. Während der Rückfahrt einen Tag zuvor hat sie ausgeprägte Gliederschmerzen entwickelt, jetzt kommen zunehmend grippale Beschwerden hinzu. Ihre Temperatur ist nicht erhöht. Während des Urlaubs hat die Patientin ein populärwissenschaftliches Buch über Tropenkrankheiten gelesen und ist nun überzeugt davon, Dengue-Fieber zu haben. Tropenaufenthalte liegen Jahre zurück. Der Therapeut glaubt ihr nicht, führt aber auf ihren Wunsch hin einen Test zum Nachweis von NS1 durch. Dieser ist deutlich positiv. Bei suggestivem klinischem Bild, Leuko- und Thrombopenie im Differenzialblutbild, mildem Anstieg der Transaminasenaktivität, negativem Antikörpertest gegen Dengue und negativem Stauschlauchtest wird die Patientin zunächst symptomatisch behandelt. In der Folge bestätigt ein signifikanter Antikörperanstieg zusätzlich die Selbstdiagnose der Patientin. Die Infektion klingt folgenlos nach einer Woche ab.
|
Die kritische Phase mit einer Temperatur von etwa 37,5–38,0°C oder weniger an den Tagen 3–7 ist durch eine vorübergehende Entfieberung gekennzeichnet (s. [ Abb. 3 ] ). Sie ist mit einer erhöhten Kapillardurchlässigkeit verbunden. Diese Phase dauert in der Regel 1–2 Tage. Der Beginn der kritischen Phase wird von einem raschen Rückgang der Thrombozytenzahl und einem Anstieg des Hämatokritwerts begleitet; der Patient kann bis zu 24 h vor dem Absinken der Thrombozytenzahl eine Leukopenie aufweisen. Die kritische Phase kann mit Schock, Organfunktionsstörungen, disseminierter intravasaler Gerinnung oder Blutungen einhergehen.
In der Erholungsphase kommt es innerhalb von 2–3 Tagen zu einer allmählichen Rückresorption der extravaskulären Flüssigkeit. Der Patient weist in dieser Zeit oft eine Bradykardie auf. Zu den häufigen Laborbefunden gehören Thrombozytopenie. Leukopenie und erhöhte Transaminasenaktivitäten.
Kompliziertes Dengue-Syndrom
Das komplizierte Dengue-Syndrom bezieht sich auf ungewöhnliche oder atypische Manifestationen bei Patienten mit Dengue-Fieber mit neurologischer, hepatischer, renaler und anderer isolierter Organbeteiligung. Zu den neurologischen Manifestationen gehören Fieberkrämpfe bei Kleinkindern, Enzephalitis, aseptische Meningitis und intrakranielle Blutungen. Eine gastrointestinale Beteiligung kann sich in Form von Hepatitis, Pankreatitis oder akalkulöser Cholezystitis äußern. Während ein mäßiggradiger Anstieg der Transaminasenaktivität bei Dengue nicht ungewöhnlich ist, sind schwere Manifestationen bis hin zum Leberversagen zwar beschrieben, aber selten. Weitere Komplikationen beinhalten Myokarditis, Perikarditis, akutes Lungenversagen, akute Nierenschädigung oder ein hämolytisch-urämisches Syndrom [ 12 ] . Schwere Verläufe sind sowohl bei Kindern als auch bei Erwachsenen möglich. Während sie bei Primärinfektionen sehr selten sind, treten sie in einer Größenordnung von etwa 2–4% bei Sekundärinfektionen auf.
|
Merke Eine noch wenig erforschte, aber regelmäßig zu beobachtende Langzeitfolge der Infektion ist ein Fatigue-Syndrom, das sich im Anschluss an die Akutphase manifestiert und über Monate bis in Einzelfällen auch 2 Jahre anhalten kann.
|
In der Literatur sind dazu Manifestationsraten von 7–53% zu finden [ 13 ] . Eine Datenauswertung in der eigenen Sprechstunde ergab ein Chronic-Fatigue-Syndrom bei 9,6% der Patienten mit symptomatischem Dengue-Fieber.
|
Fallbeispiel Chronic-Fatigue-Syndrom bei Dengue-Fieber Eine 36-jährige Patientin stellt sich 2 Wochen nach ihrer vierwöchigen Mexikoreise vor. Zwei Wochen nach Reisebeginn kam es zu einer akuten grippalen Symptomatik, ausgeprägten Gliederschmerzen, Fieber und Kopfschmerzen. Ein Exanthem ist ihr nicht erinnerlich. Die Symptome bildeten sich gegen Ende der Reise unter symptomatischer Therapie mit Ibuprofen zurück. Die Patientin leidet seit ihrer Rückkehr unter einer anhaltenden Erschöpfungssymptomatik mit Leistungsschwäche, wechselnden Gelenkschmerzen, Schlaf-, Konzentrations- und Wortfindungsstörungen. Zudem imponieren Palpitationen und eine ausgeprägte Tachykardie schon bei geringer Belastung. Die bereits erfolgte kardiologische Abklärung war unauffällig. Ebenso finden sich keine auffälligen Parameter bei den Entzündungswerten, der Endokrinologie und der Rheumaserologie. Es liegen keine Vorerkrankungen und keine Dauermedikation vor. Der klinische Untersuchungsbefund der Patientin ist unauffällig. Serologisch wird ein Dengue-Fieber durch Nachweis von hochtitrigen IgM- und IgG- (Immunglobulin-M- und -G-)Antikörpern bestätigt; die IgG-Titer steigen im weiteren Verlauf noch an. Unter der Verdachtsdiagnose eines Chronic-Fatigue-Syndroms nach Dengue-Fieber wird die Patientin ambulant betreut. Vom Umfeld und auch vom Hausarzt wird die Diagnose nicht anerkannt. Die Patientin ist über 2 Jahre arbeitsunfähig. Dennoch bessert sich die Symptomatik im Verlauf allmählich, sodass sie nach 2,5 Jahren angibt, weitgehend wiederhergestellt zu sein.
|
Dengue bei Reisenden
Bei Reisenden, die aus Endemiegebieten zurückkehren, stellt Dengue heute eine der häufigsten Ursachen für Fieber dar [ 10 ] . Gemäß einer aktuellen Auswertung ist mit einer Größenordnung von bis zu ca. 20–30 Dengue-Infektionen pro 100 000 Rückkehrern aus beliebten Reiseländern in Asien zu rechnen [ 14 ] .
|
Merke Es ist zu beachten, dass sich Dengue aufgrund seiner kurzen Inkubationszeit meist noch im Reiseland manifestiert. Die Meldezahlen in Europa bilden daher mit Sicherheit nur einen kleinen Anteil der tatsächlichen Fallzahlen bei Reisenden ab.
|
Auch wenn das Fieber meist selbstlimitierend ist, wird doch regelmäßig eine ambulante oder sogar stationäre Behandlung während oder nach der Reise notwendig. Diese geht, abgesehen von der Morbidität, mit einer Unterbrechung oder einem Abbruch der Reise sowie mit Kosten für die Betroffenen und das Gesundheitswesen einher [ 10 ] . In Europa wurden zwischen 2015 und 2019 insgesamt 11 478 Dengue-Fälle bei Reiserückkehrern aus 110 Herkunftsländern gemeldet [ 14 ] . Davon entfielen 4363 Fälle allein auf das Jahr 2019 [ 15 ] . Von den Betroffenen hatten sich 71% in Asien (insbesondere Südostasien), 18% in der Karibik, in Südamerika und in Zentralamerika, 8% in Afrika und 3% in Ozeanien infiziert. Im Durchschnitt traten 2,8 Dengue-Fälle pro 100 000 Reisenden auf. Dabei wurden höhere Zahlen bei Rückkehrern aus Asien (6,1:100 000) und sehr hohe Zahlen bei Rückkehrern aus einzelnen beliebten Urlaubsländern wie z.B. Thailand (19,6:100 000) oder Indonesien (29:100 000) verzeichnet [ 14 ] . Die Prognosen für die Jahre nach der Corona-Pandemie gehen aufgrund der steigenden Reiseaktivität und auch der Zunahme der globalen Dengue-Infektionen von einem erheblichen Anstieg aus. Assoziationen einer Dengue-Infektion mit der Reisedauer zeigen sich auch bei der Auswertung großer Datenbanken nicht [ 16 ] . Die Infektion stellt auch für Kurzzeitaufenthalte in Risikogebieten eine relevante Größe dar. Dabei zeigen Studien bei Reiserückkehrern eine Prävalenz von DHF unter den Dengue-Fällen von 0,9–3,0% [ 17 ] [ 18 ] [ 19 ] . Vorerkrankungen scheinen ein Risko für Komplikationen darzustellen. In diesem Zusammenhang werden insbesondere Adipositas, Diabetes Typ 2, arterielle Hypertonie, Rheuma, chronische obstruktive Lungenerkrankungen, Karzinome, Herzinsuffizienz, neurologische Erkrankungen und chronische Niereninsuffizienz in den Vordergrund gestellt [ 16 ] .
|
Fallbeispiel Dengue-Fieber bei einer Reiserückkehrerin Eine 38-Jährige wacht nach einer Woche Aufenthalt auf den Seychellen mit massiven Schmerzen der Arme und Beine sowie erheblichen Kopfschmerzen auf. Kurz entschlossen fliegt sie nach Hause und stellt sich 2 Tage später in der Ambulanz vor. Dort findet sich eine subjektiv sehr unter ihren Schmerzen leidende, exsikkierte Patientin mit einem deutlichen, extremitäten- und rumpfbetonten makulösen Exanthem. Die weitere körperliche Untersuchung ist unauffällig. Die Patientin gibt an, 2 Tage zuvor einmalig Teerstuhl beobachtet zu haben. Aufgrund der Gliederschmerzen lässt sie den Stauschlauchtest nur unter Protest durchführen; dieser ist negativ. Im Differenzialblutbild fällt eine Thrombopenie von 80 000/μl bei ansonsten unauffälligen Werten auf. Der NS1-Schnelltest ist deutlich positiv, der Dengue-Antikörper-Schnelltest negativ. Aufgrund der anamnestischen Angabe eines Teerstuhls wird der Patientin eine stationäre Beobachtung angetragen, die sie verweigert. Es werden tägliche ambulante Kontrollen vereinbart. Im Verlauf der nächsten 7 Tage bessert sich die Symptomatik unter Therapie mit Metamizol und reichlich oraler Flüssigkeitssubstitution allmählich, das Exanthem beginnt abzublassen. Blutungsstigmata treten nicht auf, die Thrombozytenzahl fällt nicht weiter ab. Ein Haemoccult-Test ist negativ. Die Patientin wird mit der Diagnose einer Dengue-Erstinfektion aus der ambulanten Betreuung entlassen. Der subjektive Eindruck des Teerstuhls war vermutlich durch die Exsikkose entstanden.
|
Diagnose und Differenzialdiagnose
Häufig ist bei klassischem Dengue der klinische Verdacht führend, insbesondere bei Manifestation der Gliederschmerzen und des suggestiven Virusexanthems. Im Differenzialblutbild finden sich typischerweise eine Leuko- und vor allem eine Thrombopenie. Letztere ist jedoch nicht prädiktiv für die Manifestation von Blutungen. In der klinischen Chemie zeigt sich regelmäßig ein Anstieg der Transaminasenaktivität als Zeichen der bei Dengue häufigen Begleithepatitis. In aller Regel klingt diese im Akutverlauf schnell wieder ab und bedarf keiner spezifischen Maßnahmen.
Diagnostisch ist der Nachweis von virusspezifischem NS1-Antigen hilfreich [ 11 ] . Neben der Labordiagnostik, die mittlerweile in zahlreichen Routinelabors verfügbar ist, sind dafür auch Schnelltests verfügbar, deren Spezifität zwar hoch, deren Sensitivität jedoch etwas eingeschränkt ist. Eine RT-PCR (Reverse Transcriptase Polymerase Chain Reaction) ist ebenfalls möglich, wird jedoch nur selten durchgeführt. Der Virusnachweis selbst ist aufwendig und kann zuverlässig nur in der Frühphase der Infektion erfolgen. Im Verlauf kann ein Anstieg des Antikörpertiters dokumentiert werden, der in der Akutphase der Erkrankung jedoch noch nicht nachweisbar ist. Dennoch ist ein Nachweis von Antikörpern gegen Dengue auch in dieser Phase hilfreich, da er auf eine frühere Infektion und somit auf mögliche Komplikationen hinweist. Auch dafür sind Schnelltests verfügbar. Ein positiver Stauschlauchtest (Rumpel-Leede) weist früh auf eine mögliche Blutungsneigung hin, ist jedoch nicht sehr spezifisch ( [ Abb. 6 ] ) [ 7 ] [ 20 ] . Somit kann ein Verdacht auf Dengue in der Sprechstunde im günstigsten Fall direkt per NS1-Schnelltests bestätigt werden. Zudem kann die Möglichkeit eines komplizierten Verlaufs aufgrund eines ADE in den nächsten Tagen per Antikörperschnelltest abgeklärt werden, und die aktuelle Gefäßsituation kann mittels Stauschlauchtest erfasst werden.
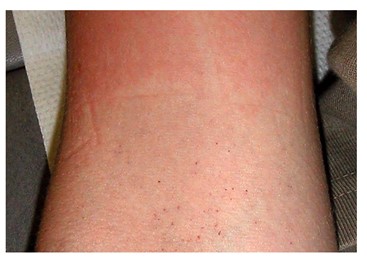
Abb. 6 Petechien nach einem Rumpel-Leede-Test. Quelle: Jelinek T. Dengue-Fieber. In: Jelinek T, Hrsg. Kursbuch Reisemedizin. 1. Aufl. Stuttgart: Thieme; 2012. doi:10.1055/b-002-41849.
|
Merke Differenzialdiagnostisch sollte bei fieberhaften Erkrankungen aus den Tropen immer auch an eine Malaria gedacht werden. |
Die Manifestation einer mittlerweile auch recht häufigen Chikungunya-Infektion und das seltene, aber sich ebenfalls ausbreitende Zika-Fieber sind wichtige Differenzialdiagnosen, die im Regelfall nur retrospektiv in der Serologie geklärt werden können.
Therapie
Die Behandlung des Dengue-Fiebers ist symptomatisch und hängt von der Krankheitsphase des Patienten ab [ 7 ] [ 11 ] :
- Patienten, die sich früh und ohne Warnzeichen vorstellen, können ambulant mit ausreichender oraler Flüssigkeitszufuhr und symptomatischer Therapie behandelt werden. Dabei hat sich vor allem Metamizol bewährt, das regelmäßig einen guten Effekt gegen die Gliederschmerzen zeigt.
- Patienten mit Warnzeichen oder schwerem Dengue-Fieber sollten stationär aufgenommen werden.
Die Gabe von Erythrozytenkonzentraten kann bei schweren Blutungen oder bei Verdacht auf Blutungen gerechtfertigt sein, wenn der Patient instabil bleibt und der Hämatokritwert trotz angemessener Flüssigkeitssubstitution sinkt. Eine Thrombozytengabe wird in Betracht gezogen, wenn die Thrombozytenzahl auf weniger als 20 000 Zellen/μl sinkt und ein hohes Blutungsrisiko besteht. Die Gabe von Aspirin und nicht steroidalen Antirheumatika sowie anderen Antikoagulanzien ist zu vermeiden. Eine spezifische antivirale Therapie ist nicht etabliert. Die Gabe von Ivermectin wurde in thailändischen Studien untersucht und zeigte trotz der Besserung einzelner Laborparameter keinen klinischen Effekt [ 21 ] . Sie wird daher nicht empfohlen. Monoklonale Antikörper zur Therapie des DHF befinden sich in Zulassung. Dabei stehen insbesondere Antikörper gegen NS1 im Vordergrund [ 22 ] . Laborparameter mit prädiktivem Wert für die Manifestation von Komplikationen sind nicht etabliert. Unbehandeltes schweres Dengue-Fieber kann eine Sterblichkeitsrate von 10–20% haben. Eine angemessene unterstützende Behandlung senkt die Sterblichkeitsrate auf unter 1%.
|
Fallbeispiel Zu spät behandeltes Dengue-Fieber Eine 50-jährige Frau mit Diabetes Typ 2 reist mit ihrem Mann in der Vorweihnachtszeit nach Thailand. Direkt nach ihrer Rückkehr begeben sich beide in ihre Skihütte in den Bergen Norwegens, wo sie die Weihnachtstage verbringen wollen. Aufgrund starker Schneefälle werden sie eingeschneit. Drei Tage nach ihrer Ankunft bilden sich bei der Frau akut starke Schmerzen am ganzen Körper aus, zudem Fieber bis 39,5°C. Da an eine Abreise nicht zu denken ist, behandelt sich die Patientin mit Ibuprofen und reichlich Flüssigkeitszufuhr. Über 3 Tage halten Schmerzen und Fieber an, der Zustand der Patientin bleibt aber stabil. Am 4. Tag nach Symptombeginn kommt es zu einem deutlichen Pulsanstieg, die Patientin wird kreislaufinstabil und trübt ein. Der Ehemann bringt sie in einer mehrstündigen und sehr schwierigen Fahrt in das nächste Krankenhaus. Dort imponiert eine Schocksymptomatik bei erheblicher Thrombopenie (15 000/µl). Versuche zur Stabilisierung der Patientin schlagen fehl, sie stirbt am 7. Tag nach Symptombeginn an Kreislaufversagen. Aus einer bei der Aufnahme entnommenen Blutprobe kann mittels RT-PCR Dengue Typ 1 nachgewiesen werden. In der Serologie sind keine Antikörper gegen Dengue nachweisbar. Somit ist ein Dengue-Schocksyndrom bei Erstinfektion mit Dengue Typ 1 bestätigt, eine sehr seltene Komplikation.
|
Prävention
Mückenkontrolle und Antimückenschutz
Zu den wichtigsten Präventivmethoden in betroffenen Gebieten auf Public-Health-Ebene gehören Maßnahmen zur Mückenkontrolle [ 7 ] [ 11 ] [ 15 ] . Dabei kommen neben chemischen Methoden wie Insektiziden zunehmend auch biologische Bekämpfungsmaßnahmen zum Einsatz. In den letzten Jahren hat sich in diesem Zusammenhang insbesondere das Ausbringen von Aedes-aegypti-Mücken bewährt, die mit Wolbachia-Bakterien infiziert wurden. Diese sind deutlich weniger anfällig für eine Dengue-Fieber-Virusinfektion als der Wildtyp [ 23 ] .
Persönliche prophylaktische Maßnahmen zum Mückenschutz beinhalten
- die Verwendung von Moskitonetzen auch tagsüber,
- mit Insektiziden behandelte Materialien wie Fenstervorhänge,
- das Auftragen von Repellenzien auf die Haut (mit DEET, IR3535 oder Icaridin) und
- das Tragen von langärmeligen Hemden und langbeinigen Hosen.
Bei den mit Kontrollversuchen mit Tigermücken in den letzten Jahrzehnten gemachten Erfahrungen offenbart sich häufig eine gewisse Hilflosigkeit, da sich die Mückenpopulationen trotz aller Maßnahmen nahezu unaufhaltsam ausgebreitet haben.
|
Merke Allenfalls das schon erwähnte, methodisch aufwendige Ausbringen von Wolbachia-infizierten Aedes-Moskitos scheint die Übertragung von Dengue regional kurzfristig um mehr als 85% zu senken [ 24 ] . |
Es bleibt abzuwarten, ob diese Methode nachhaltige, langjährige Effekte zeigen kann.
Impfung
In Anbetracht der massiven Ausbreitung von Dengue und der erheblichen globalen Fallzahlen ist nachvollziehbar, dass seit über 2 Jahrzehnten mit Hochdruck an einem Impfstoff gearbeitet wird. Dies stellt jedoch eine erhebliche Herausforderung dar, da eine möglichst protektive Immunreaktion gegen alle 4 Serotypen erreicht werden muss, um eine effektive Impfung zu erhalten. Genau betrachtet wird an einer Kombinationsvakzine aus 4 Impfungen gearbeitet, nicht an einem einzigen Impfstoff. In Anbetracht des bekannten Immunphänomens des ADE, das zu kompliziertem Dengue bis hin zum DHF führen kann, galt es von Anfang an, ein ähnliches Phänomen durch die Impfung zu verhindern. Kommen geimpfte Populationen bei einem Ausbruch mit einem Wildvirus in Kontakt, darf es nicht zu einer Verstärkung der Effekte der Wildinfektion durch die bereits aufgrund der Impfung vorliegenden Antikörper kommen. Daher wurden insbesondere die neueren Impfstoffkandidaten ausgiebig in langjährigen klinischen Studien in Endemiegebieten getestet.
In Europa sind 2 Impfstoffe gegen Dengue zugelassen.
CYD-TDV (Dengvaxia)
Seit einigen Jahren ist CYD-TDV (Dengvaxia) zugelassen [ 25 ] , ein rekombinanter tetravalenter Dengue-Lebendimpfstoff. Dabei handelt es sich um einen attenuierten Lebendimpfstoff basierend auf dem Gelbfieberimpfvirus. Das Impfschema sieht 3 Impfungen in den Monaten 0, 6 und 12 vor. CYD-TDV ist für Personen zwischen 9 und 45 Jahren zugelassen, die in Endemiegebieten leben und bei denen eine durchgemachte Dengue-Virusinfektion dokumentiert ist. Für Reisende aus Deutschland steht dieser Impfstoff außerhalb der Verbreitungsgebiete nicht zur Verfügung. Die protektive Effektivität ist begrenzt, mit ca. 60–70% bei Personen mit bereits durchgemachter Infektion und ca. 20% bei immunologisch naiven Personen. Darüber hinaus besteht bei Letzteren nach der Impfung das Risiko der Entwicklung eines schweren Verlaufs bei Kontakt mit einem Wildvirus [ 26 ] . Hintergrund dieses Phänomens ist vermutlich das Fehlen einer Immunantwort gegen NS1. Wie oben ausgeführt, spielt dieses Protein eine wichtige Rolle bei der Ausbildung von Komplikationen. Anti-NS1-Antikörper scheinen einen Schutz vor dem ADE-Phänomen und damit vor den wesentlichen Komplikationen zu bieten. Diese können aber durch CYD-TDV nicht induziert werden, da das Antigen im Gelbfieberimpfvirus nicht exprimiert wird. Es wird ausschließlich eine Immunantwort gegen das Hüllprotein der Dengue-Viren aufgebaut, die zwar eine sehr gute Immunogenität, aber nur eine begrenzte protektive Effektivität bedingt.
TAK-003 (Qdenga)
Seit Ende 2022 ist TAK-003 (Qdenga) zugelassen [ 27 ] , ebenfalls ein tetravalenter Lebendimpfstoff, der jedoch auf einem attenuierten DEN2-Virus basiert. Dieser Impfstoff ist seit Februar 2023 in Deutschland verfügbar und für alle Altersgruppen ab dem vollendeten 4. Lebensjahr zugelassen. In den Zulassungsstudien wurde eine protektive Effektivität von 80,2% gegen Dengue-Fieber und von 90,4% gegen Hospitalisierung nachgewiesen. Die Impfung wird zweimalig mit einem Mindestabstand von 3 Monaten verabreicht. Bereits nach der ersten Impfung wurde eine Protektion von 81,1% gegen Dengue nachgewiesen. Bei genauerer Betrachtung der Daten zeigt sich allerdings, dass der Schutz gegen die 4 Serotypen ungleich verteilt ist. Bei bereits Seropositiven konnte auch bei diesem Impfstoff eine effektivere Schutzwirkung gegen Hospitalisierung demonstriert werden [ 27 ] , und zwar von 66,8% gegen DEN1, von 95,8% gegen DEN2 und von 74% gegen DEN3. Der Effekt gegen DEN4 war nicht signifikant, da zu wenige Fälle in der Studienpopulation vorkamen. Bei Nichtimmunen lag der Schutz gegen Hospitalisierung bei 78,4% gegen DEN1, bei 100% gegen DEN2 und bei 87,9% gegen DEN3. Das letzte Ergebnis war aufgrund der großen Streubreite der Daten nicht signifikant. Gegen DEN4 konnte ebenfalls aufgrund der geringen Fallzahlen kein Schutz nachgewiesen werden. Die mangelnde Signifikanz der Protektion gegen DEN4 erscheint aufgrund des seltenen Vorkommens dieses Serotyps nicht problematisch. Dagegen stellt der fehlende Schutz gegen DEN3 bei Nichtimmunen eine relevante Lücke dar. Dazu müssen sicherlich weitere Untersuchungen und ggf. auch eine Anpassung des Impfstoffs folgen. Ein für die Zulassung entscheidendes Ergebnis war, dass es bei TAK-003 im Gegensatz zu CYD-TDV in der Nachbeobachtung über nahezu 5 Jahre kein Sicherheitssignal im Hinblick auf die Entwicklung eines schweren Verlaufs bei Kontakt mit einem Wildvirus gab. Die weitere Nachbeobachtung hält an; bisher wurden keine bedenklichen Sicherheitssignale gesehen. Per Zulassung ist bereits eine Impfung vor Exposition ausreichend, die 2. dient der Verlängerung des Langzeitschutzes. Eine Kombination mit anderen Lebend- und auch mit Totimpfstoffen ist möglich.
Seitens der Verträglichkeit finden sich neben den üblichen Lokal- und Allgemeinreaktionen nach Impfung vor allem 2 Phänomene, auf die hingewiesen werden sollte:
- Wie bei anderen Lebendimpfstoffen auch manifestiert sich häufig eine über Wochen anhaltende Rötung über der Impfstelle, die auch überwärmt sein kann ( [ Abb. 7 ] ).
- Zudem bildet sich bei geschätzt ca. 5% der Geimpften in der 2. Woche nach der Impfung ein makulöses, rumpfbetontes, oft juckendes Exanthem, das mehrere Tage bis eine Woche anhalten kann ( [ Abb. 8 ] ).
|
Merke Die Lebendimpfung mit Dengue-Impfstoffen ist kontraindiziert bei Immunsupprimierten, Schwangeren und Stillenden.
|
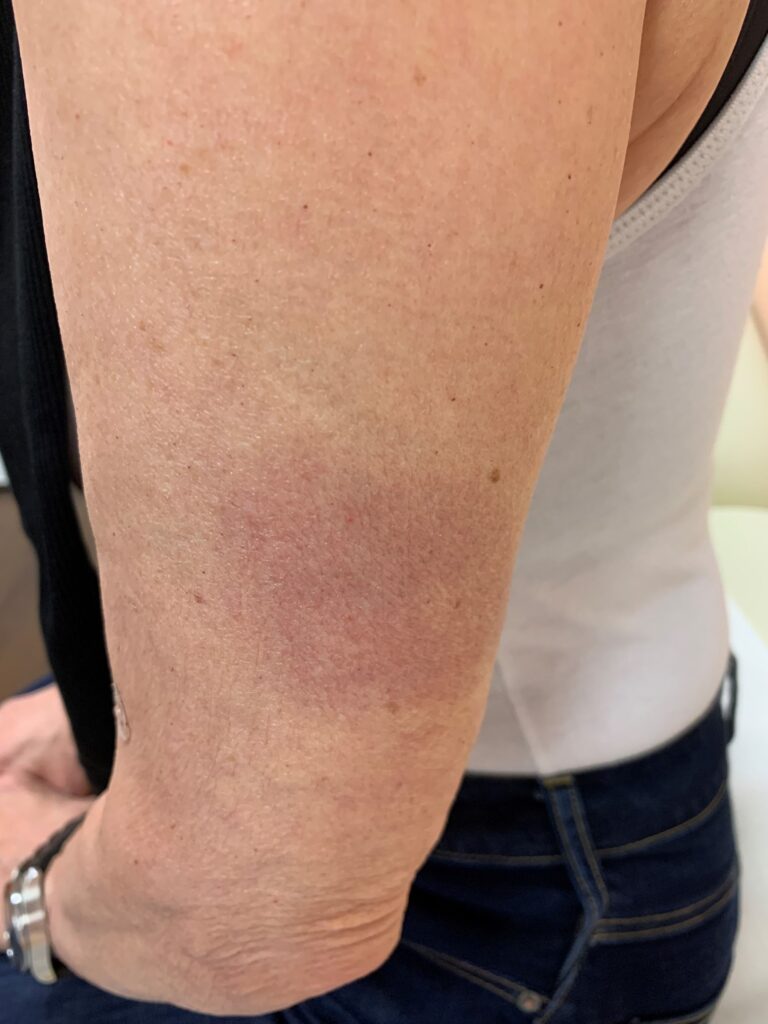
Abb. 7 Lokalreaktion nach Impfung mit Qdenga
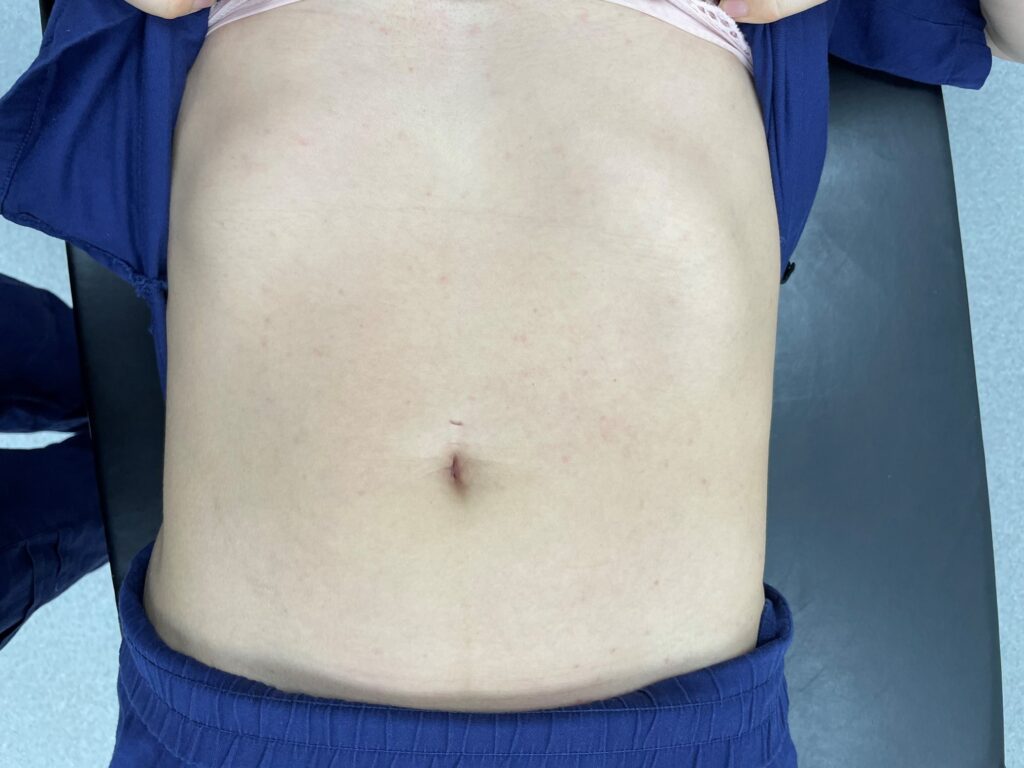
Abb.8 Juckendes, makulöses rumpfbetontes Exanthem in der 2. Woche nach der Impfung mit Qdenga
Vergleich und Bewertung beider Impfstoffe
In Zusammenschau stellen beide Impfstoffe sicherlich keine idealen Vakzine dar. Jedoch bietet TAK-003 eine deutliche Protektion gegen ein in zahlreichen Ländern sehr häufiges Virus, das schwere Krankheitsmanifestationen und in seltenen Fällen auch tödliche Komplikationen verursachen kann. Die Impfung bietet deutlich besseren Schutz als die reine Expositionsprophylaxe, die die einzige Alternative darstellt. Darüber hinaus ist sie in ihrer protektiven Effektivität anderen Vakzinen, die in der Reisemedizin verwendet werden, zumindest gleichwertig. Für betroffene Populationen in Endemiegebieten, aber auch für Reisende in solche Gebiete stellt die Impfung einen wesentlichen Vorteil dar. Eine gebremste Umsetzung der jetzt verfügbaren Möglichkeit zur Prävention setzt Betroffene einem unnötigen Risiko durch die Infektion aus [ 28 ] . Insofern empfiehlt sich die Impfung entsprechend der Zulassung aktuell insbesondere für Reisende in Risikogebiete, die durch Epidemien oder endemische Situationen betroffen sind. Bei niedriger Inzidenz von Dengue am Reiseziel oder lediglich Vorkommen von kleinen, lokalen Ausbrüchen muss die Impfung sicherlich nicht vordringlich empfohlen werden.
|
Kernaussagen
|
Literatur
- [1] World Health Organisation (WHO). Ten threats to global health in 2019. https://www.who.int/news-room/spotlight/ten-threats-to-global-health-in-2019 (Zugriff: 11.10.2023)
- [2] Wilder-Smith A, Gubler DJ, Weaver SC. et al.. Epidemic arboviral diseases: priorities for research and public health.Lancet Infect Dis 2017; 17: e101-e106.
-
[3] Jelinek T. CRM Handbuch Reisemedizin 2022. 58. Auflage. Düsseldorf: CRM Centrum für Reisemedizin; 2021
- [4] World Health Organisation (WHO). Dengue and severe dengue, 2023. https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue (Zugriff: 11.10.2023)
- [5] European Centre for Disease Prevention and Control (ECDC). Dengue worldwide overview. Situation update, 23 August 2023. Stockholm: ECDC; 2023. https://www.ecdc.europa.eu/en/dengue-monthly (Zugriff: 25.09.2023)
- [6] European Centre for Disease Prevention and Control (ECDC). Autochthonous transmission of dengue virus in mainland EU/EEA, 2010–present. Stockholm: ECDC; 2023. https://www.ecdc.europa.eu/en/all-topics-z/dengue/surveillance-and-disease-data/autochthonous-transmission-dengue-virus-eueea (Zugriff: 11.10.2023)
- [7] World Health Organisation (WHO), Regional Office for South-East Asia. Comprehensive guideline for prevention and control of dengue and dengue haemorrhagic fever. New Delhi: WHO, Regional Office for South-East Asia; 2011. https://iris.who.int/handle/10665/204894 (Zugriff: 11.10.2023)
- [8] Katzelnick LC, Coloma J, Harris E. Dengue: knowledge gaps, unmet needs, and research priorities. Lancet Infect Dis 2017; 17: e88-e100
- [9] Oliveira LNDS, Itria A, Lima EC. Cost of illness and program of dengue: a systematic review. PLoS One 2019; 14: e0211401
- [10] Halstead S, Wilder-Smith A. Severe dengue in travellers: pathogenesis, risk and clinical management. J Travel Med 2019; 26: taz062
- [11] Wilder-Smith A, Ooi EE, Horstick O. et al. Dengue. Lancet 2019; 393: 350-363
- [12] Wharton-Smith A, Green J, Loh EC. et al. Using clinical practice guidelines to manage dengue: a qualitative study in a Malaysian hospital. BMC Infect Dis 2019; 19: 45
- [13] Tiga DC, Undurraga EA, Ramos-Castanedan J. et al. Persistent symptoms of dengue: estimates of the incremental disease and economic burden in Mexico. Am J Trop Med Hyg 2016; 94: 1085-1089
- [14] Gossner CM, Fournat E, Frank C. et al. Dengue virus infections among European travellers, 2015 to 2019. Euro Surveill 2022; 27: 2001937
- [15] European Centre for Disease Prevention and Control (ECDC). Dengue. Annual epidemiological report for 2019. Stockholm: ECDC; 2021. https://www.ecdc.europa.eu/sites/default/files/documents/AER-dengue-2019.pdf (Zugriff: 11.10.2023)
- [16] Huits R, Angelo KM, Amatya B. et al. Clinical characteristics and outcomes among travelers with severe dengue : a GeoSentinel analysis. Ann Intern Med 2023; 176: 940-948
- [17] Jelinek T, Mühlberger N, Harms G. et al. Epidemiology and clinical features of imported dengue fever in Europe: sentinel surveillance data from TropNetEurop. Clin Infect Dis 2002; 35: 1047-1052
- [18] Schwartz E, Weld LH, Wilder-Smith A. et al. Seasonality, annual trends, and characteristics of dengue among ill returned travelers, 1997–2006. Emerg Infect Dis 2008; 14: 1081-1088
- [19] Wilder-Smith A, Tambyah PA. Severe dengue virus infection in travelers. J Infect Dis 2007; 195: 1081-1083
- [20] Jelinek T. Dengue-Fieber. In: Jelinek T, Hrsg. Kursbuch Reisemedizin. 1. Aufl. Stuttgart: Thieme; 2012
- [21] Suputtamongkol Y, Avirutnan P, Mairiang D. et al. Ivermectin accelerates circulating nonstructural protein 1 (NS1) clearance in adult dengue patients: a combined phase 2/3 randomized bouble-blinded placebo controlled trial. Clin Infect Dis 2021; 72: e586-e593
- [22] Tien SM, Chang PC, Lai YC. et al. Therapeutic efficacy of humanized monoclonal antibodies targeting dengue virus nonstructural protein 1 in the mouse model. PLOS Pathogens 2022
- [23] Flores HA, Taneja de Bruyne J, O’Donell TB. et al. Multiple Wolbachia strains provide comparative levels of protection against dengue virus infection in Aedes aegypti. PLoS Pathog 2020; 16: e1008433
- [24] Utarini A, Indriani C, Ahmad RA. et al. Efficacy of Wohlbachia-infected mosquito deployments for the control of dengue. N Eng J Med 2021; 384: 2177-2186
- [25] Paul Ehrlich Institut. Denguefieber-Impfstoffe. Dengvaxia, 2023. https://www.pei.de/DE/arzneimittel/impfstoffe/denguefieber/dengue-inhalt.html (Zugriff: 11.10.2023)
- [26] Thomas ST, Yoon IK. A review of Dengvaxia: development to deployment. Hum Vaccine Immunother 2019; 15: 2295-2314
- [27] Paul Ehrlich Institut. Denguefieber-Impfstoffe. Qdenga, 2023. https://www.pei.de/DE/arzneimittel/impfstoffe/denguefieber/dengue-inhalt.html (Zugriff: 11.10.2023)
- [28] Thomas SJ. Is new dengue vaccine efficacy data a relief or cause for concern?. npj Vaccines 2023; 8: 55
- [29] Wilder-Smith A, Gubler DJ, Weaver SC. et al.. Epidemic arboviral diseases: priorities for research and public health.Lancet Infect Dis 2017; 17: e101-e106.
Quelle
Jelinek T. Dengue-Fieber. Reisemedizin up2date 2024; 01(01): 17 – 31. doi:10.1055/a-2176-0823
eRef-Link: https://eref.thieme.de/ejournals/2940-8113_2024_01#/10.1055-a-2176-0823